Quantidade de substância, mol, massa molar e volume molar. Encontrando o volume molar dos gases
A massa de 1 mol de uma substância é chamada de molar. Como é chamado o volume de 1 mol de uma substância? Obviamente, isso também é chamado de volume molar.
Qual é o volume molar da água? Quando medimos 1 mol de água, não pesamos 18 g de água na balança - isso é inconveniente. Utilizamos utensílios de medição: um cilindro ou um copo, pois sabíamos que a densidade da água é de 1 g/ml. Portanto, o volume molar da água é 18 ml/mol. Para líquidos e sólidos, o volume molar depende da sua densidade (Fig. 52, a). A questão é diferente para os gases (Fig. 52, b).
Arroz. 52.
Volumes molares (n.s.):
a - líquidos e sólidos; b - substâncias gasosas
Se você tomar 1 mol de hidrogênio H2 (2 g), 1 mol de oxigênio O2 (32 g), 1 mol de ozônio O3 (48 g), 1 mol de dióxido de carbono CO2 (44 g) e até 1 mol de vapor de água H2 O (18 g) nas mesmas condições, por exemplo normais (em química costuma-se chamar condições normais (n.s.) de temperatura de 0 ° C e pressão de 760 mm Hg, ou 101,3 kPa), então acontece que 1 mol de qualquer um dos gases ocupará o mesmo volume, igual a 22,4 litros, e conterá o mesmo número de moléculas - 6 × 10 23.
E se você consumir 44,8 litros de gasolina, quanto será consumido de sua substância? Claro, 2 moles, já que o volume dado é o dobro do volume molar. Por isso:
onde V é o volume do gás. Daqui
O volume molar é uma quantidade física igual à razão entre o volume de uma substância e a quantidade de substância.
O volume molar das substâncias gasosas é expresso em l/mol. VM - 22,4 l/mol. O volume de um quilomole é denominado quilomolar e é medido em m 3 /kmol (Vm = 22,4 m 3 /kmol). Consequentemente, o volume milimolar é 22,4 ml/mmol.
Problema 1. Encontre a massa de 33,6 m 3 de amônia NH 3 (n.s.).

Problema 2. Encontre a massa e o volume (n.v.) de 18 × 10 20 moléculas de sulfeto de hidrogênio H 2 S.
Ao resolver o problema, prestemos atenção ao número de moléculas 18 × 10 20. Como 10 20 é 1.000 vezes menor que 10 23, obviamente, os cálculos devem ser realizados usando mmol, ml/mmol e mg/mmol.

Palavras-chave e frases
- Volumes molares, milimolares e quilomolares de gases.
- O volume molar dos gases (em condições normais) é 22,4 l/mol.
- Condições normais.
Trabalhar com computador
- Consulte o requerimento eletrônico. Estude o material da lição e conclua as tarefas atribuídas.
- Encontre endereços de e-mail na Internet que possam servir como fontes adicionais que revelam o conteúdo das palavras-chave e frases do parágrafo. Ofereça sua ajuda ao professor na preparação de uma nova aula - faça um relatório sobre as palavras e frases-chave do próximo parágrafo.
Perguntas e tarefas
- Encontre a massa e o número de moléculas em n. você. para: a) 11,2 litros de oxigênio; b) 5,6 m3 de nitrogênio; c) 22,4 ml de cloro.
- Encontre o volume que em n. você. serão necessários: a) 3 g de hidrogênio; b) 96 kg de ozônio; c) 12 × 10 20 moléculas de nitrogênio.
- Encontre as densidades (massa 1 litro) de argônio, cloro, oxigênio e ozônio à temperatura ambiente. você. Quantas moléculas de cada substância estarão contidas em 1 litro nas mesmas condições?
- Calcule a massa de 5 litros (n.s.): a) oxigênio; b) ozônio; c) dióxido de carbono CO 2.
- Indique o que é mais pesado: a) 5 litros de dióxido de enxofre (SO 2) ou 5 litros de dióxido de carbono (CO 2); b) 2 litros de dióxido de carbono (CO 2) ou 3 litros de monóxido de carbono (CO).
Das disposições de que um mol de qualquer substância inclui um número de partículas desta substância igual ao número de Avogadro, e que números iguais de partículas de gases diferentes, sob as mesmas condições físicas, estão contidos em volumes iguais desses gases, segue-se o seguinte:
quantidades iguais de quaisquer substâncias gasosas sob as mesmas condições físicas ocupam volumes iguais
Por exemplo, o volume de um mol de qualquer gás tem (em p,T = const) o mesmo significado. Conseqüentemente, a equação para uma reação que ocorre com a participação de gases especifica não apenas a razão entre suas quantidades e massas, mas também seus volumes.
volume molar de um gás (V M) é o volume de gás que contém 1 mol de partículas deste gás
V M = V/n
A unidade SI de volume molar de um gás é metro cúbico por mol (m 3 /mol), mas unidades submúltiplas são usadas com mais frequência - litro (decímetro cúbico) por mol (l/mol, dm 3 /mol) e mililitro (cúbico centímetro) por mol ( cm 3 /mol).
De acordo com a definição de volume molar para qualquer gás, a razão entre seu volume V para quantidade n será o mesmo desde que seja um gás ideal.
Em condições normais (norma) - 101,3 kPa, 0°C - o volume molar de um gás ideal é igual a
V M = 2,241381·10 -2 m 3 /mol ≈ 22,4 l/mol
Nos cálculos químicos, o valor arredondado de 22,4 L/mol é usado porque o valor exato se refere a um gás ideal, e a maioria dos gases reais diferem dele em propriedades. Gases reais com temperatura de condensação de equilíbrio muito baixa (H 2, O 2, N 2) em condições normais têm um volume quase igual a 22,4 l/mol, e gases que condensam em altas temperaturas têm um volume molar ligeiramente menor em n. ano: para CO 2 - 22,26 l/mol, para NH 3 - 22,08 l/mol.
Conhecendo o volume de um determinado gás sob determinadas condições, pode-se determinar a quantidade de substâncias neste volume, e vice-versa, pela quantidade de substância em uma determinada porção do gás pode-se encontrar o volume desta porção:
n = V/VM; V = V M * n
Volume molar de gás em N.S. é uma constante física fundamental amplamente utilizada em cálculos químicos. Permite utilizar o volume de um gás em vez de sua massa, o que é muito conveniente em química analítica (analisadores de gases baseados na medição de volume), pois é mais fácil medir o volume de um gás do que sua massa.
O valor do volume molar do gás no no. é o coeficiente de proporcionalidade entre as constantes de Avogadro e Loschmidt:
V M = N A / N L = 6,022 10 23 (mol -1) / 2,24 10 4 (cm 3 /mol) = 2,69 10 19 (cm -3)
Usando o volume molar e a massa molar do gás, a densidade do gás pode ser determinada:
ρ = M / V M
Nos cálculos baseados na lei dos equivalentes para substâncias gasosas (reagentes, produtos), ao invés da massa equivalente, é mais conveniente utilizar o volume equivalente, que é a razão entre o volume de uma porção de um determinado gás e o equivalente quantidade de uma substância nesta porção:
V eq = V / n eq = V / zn = V M / z; (p, T = const)
A unidade de volume equivalente é igual à unidade de volume molar. O valor do volume equivalente de gás é uma constante de um determinado gás apenas em uma reação específica, pois depende do fator de equivalência f eq.
Volume molar de gás
Volume molar de um gás Das disposições de que um mol de qualquer substância inclui um número de partículas desta substância igual ao número de Avogadro, e que números iguais de partículas de gases diferentes ao mesmo tempo
Volume de gás em condições normais
Tópico 1
LIÇÃO 7
Assunto. Volume molar de gases. Cálculo do volume de gás em condições normais
Objetivos da aula: familiarizar os alunos com o conceito de “volume molar”; revelar as características da utilização do conceito de “volume molar” para substâncias gasosas; ensinar os alunos a utilizar os conhecimentos adquiridos para calcular o volume de gases em condições normais.
Tipo de aula: combinada.
Formas de trabalho: história do professor, prática orientada.
Equipamento: Tabela periódica de elementos químicos de D. I. Mendeleev, fichas de tarefas, cubo com volume de 22,4 l (com lado de 28,2 cm).
II. Verificando o dever de casa, atualizando conhecimentos básicos
Os alunos enviam seus trabalhos de casa concluídos nas folhas para verificação.
1) O que é “quantidade de substância”?
2) Uma unidade de medida da quantidade de uma substância.
3) Quantas partículas estão contidas em 1 mol de uma substância?
4) Qual é a relação entre a quantidade de uma substância e o estado de agregação em que essa substância se encontra?
5) Quantas moléculas de água estão contidas em 1 mol de gelo?
6) E quanto a 1 mol de água líquida?
7) Em 1 mol de vapor d'água?
8) Que massa eles terão:
III. Aprendendo novo material
Criando e resolvendo uma situação problemática Questão problemática. Que volume ocupará:
Não podemos responder a estas questões de imediato, porque o volume de uma substância depende da densidade da substância. E de acordo com a fórmula V=m/ρ, o volume será diferente. 1 mol de vapor ocupa mais volume que 1 mol de água ou gelo.
Porque em substâncias líquidas e gasosas a distância entre as moléculas de água é diferente.
Muitos cientistas estudaram substâncias gasosas. Contribuições significativas para o estudo desta questão foram feitas pelo químico francês Joseph Louis Gay-Lussac e pelo físico inglês Robert Boyle, que formularam uma série de leis físicas que descrevem o estado dos gases.
Desses padrões você conhece?
Todos os gases são igualmente comprimidos e possuem o mesmo coeficiente de expansão térmica. Os volumes dos gases não dependem do tamanho das moléculas individuais, mas da distância entre as moléculas. As distâncias entre as moléculas dependem de sua velocidade de movimento, energia e, consequentemente, temperatura.
Com base nessas leis e em suas pesquisas, o cientista italiano Amedeo Avogadro formulou a lei:
Volumes iguais de gases diferentes contêm o mesmo número de moléculas.
Em condições normais, as substâncias gasosas possuem uma estrutura molecular. As moléculas de gás são muito pequenas em comparação com a distância entre elas. Portanto, o volume de um gás é determinado não pelo tamanho das partículas (moléculas), mas pela distância entre elas, que é aproximadamente a mesma para qualquer gás.
A. Avogadro concluiu que se tomarmos 1 mol, ou seja, 6,02 x 1023 moléculas de qualquer gás, elas ocuparão o mesmo volume. Mas, ao mesmo tempo, esse volume é medido nas mesmas condições, ou seja, na mesma temperatura e pressão.
As condições sob as quais tais cálculos são realizados são chamadas de condições normais.
Condições normais (nv):
T = 273 K ou t = 0 °C
P = 101,3 kPa ou P = 1 atm. = 760 mmHg. Arte.
O volume de 1 mol de uma substância é denominado volume molar (Vm). Para gases em condições normais é de 22,4 l/mol.
É demonstrado um cubo com volume de 22,4 litros.
Tal cubo contém 6,02-1023 moléculas de quaisquer gases, por exemplo, oxigênio, hidrogênio, amônia (NH 3), metano (CH4).
Sob quais condições?
A uma temperatura de 0°C e uma pressão de 760 mm Hg. Arte.
Da lei de Avogadro segue que
onde Vm = 22,4 l/mol de qualquer gás em n. V.
Assim, conhecendo o volume de um gás, é possível calcular a quantidade de uma substância e vice-versa.
4. Formação de competências e habilidades
Pratique com exemplos
Calcule quanto volume 3 moles de oxigênio ocuparão em N. V.
Calcule o número de moléculas de óxido de carbono (IV) em um volume de 44,8 litros (n.v.).
2) Calcule o número de moléculas de C O 2 usando as fórmulas:
N (CO 2) = 2 mol · 6,02 · 1023 moléculas/mol = 12,04 · 1023 moléculas.
Resposta: 12,04 · 1023 moléculas.
Calcule o volume ocupado pelo nitrogênio pesando 112 g (atualmente).
V (N 2) = 4 mol · 22,4 l/mol = 89,6 l.
V. Lição de casa
Analise o parágrafo correspondente do livro e responda às perguntas.
Tarefa criativa (prática em casa). Resolva os problemas 2, 4, 6 do mapa de forma independente.
Tarefa de cartão para a lição 7
Calcule quanto volume 7 moles de nitrogênio N2 ocuparão (com base na corrente).
Calcule o número de moléculas de hidrogênio em um volume de 112 litros.
(Resposta: 30,1 1023 moléculas)
Calcule o volume de sulfeto de hidrogênio pesando 340 g.
Volume de gás em condições normais
Volume molar de gases. Cálculo do volume de gás em condições normais - QUANTIDADE DE SUBSTÂNCIA. CÁLCULOS POR FÓRMULAS QUÍMICAS – TODAS AS AULAS DE QUÍMICA – 8ª série – notas de aula – aulas de química – Plano de aula – Notas de aula – Planos de aula – desenvolvimento de aulas de química – QUÍMICA – Currículo escolar de nível padrão e acadêmico – todas as aulas de química para a oitava série 12- escolas de um ano
Leis do gás. Lei de Avogrado. Volume molar de gás
O cientista francês J.L. Gay-Lussac estabeleceu a lei relações volumétricas:
Por exemplo, 1 litro de cloro se conecta com 1 litro de hidrogênio , formando 2 litros de cloreto de hidrogênio ; 2 l de óxido de enxofre (IV) Conectar com 1 litro de oxigênio, formando 1 litro de óxido de enxofre (VI).
Esta lei permitiu ao cientista italiano A. Avogrado suponha que moléculas de gases simples ( hidrogênio, oxigênio, nitrogênio, cloro, etc.
) consiste em dois átomos idênticos
. Quando o hidrogênio se combina com o cloro, suas moléculas se decompõem em átomos, e estes formam moléculas de cloreto de hidrogênio. Mas como duas moléculas de cloreto de hidrogênio são formadas a partir de uma molécula de hidrogênio e uma molécula de cloro, o volume deste último deve ser igual à soma dos volumes dos gases originais.
Assim, as relações volumétricas são facilmente explicadas se partirmos da ideia da natureza diatômica das moléculas de gases simples ( H2, Cl2, O2, N2, etc.
) - Isso, por sua vez, serve como prova da natureza diatômica das moléculas dessas substâncias.
O estudo das propriedades dos gases permitiu a A. Avogadro apresentar uma hipótese, que foi posteriormente confirmada por dados experimentais, e por isso ficou conhecida como lei de Avogadro:
A lei de Avogrado implica uma importante consequência: nas mesmas condições, 1 mol de qualquer gás ocupa o mesmo volume.
Este volume pode ser calculado se a massa for conhecida 1 litro gás Em condições normais, (n.s.), ou seja, temperatura 273К (О°С) e pressão 101.325 Pa (760 mmHg) , a massa de 1 litro de hidrogênio é 0,09 g, sua massa molar é 1,008 2 = 2,016 g/mol. Então o volume ocupado por 1 mol de hidrogênio em condições normais é igual a 22,4 litros
Nas mesmas condições a massa 1l oxigênio 1,492g ; molar 32g/mol . Então o volume de oxigênio em (n.s.) também é igual a 22,4 mol.
O volume molar de um gás é a razão entre o volume de uma substância e a quantidade dessa substância:
Onde V eu - volume molar de gás (dimensão l/mol ); V é o volume da substância do sistema; n - a quantidade de substância no sistema. Entrada de exemplo: V eu gás (Bem.) =22,4 l/mol.
Com base na lei de Avogadro, são determinadas as massas molares das substâncias gasosas. Quanto maior a massa das moléculas de gás, maior será a massa do mesmo volume de gás. Volumes iguais de gases nas mesmas condições contêm o mesmo número de moléculas e, portanto, moles de gases. A proporção das massas de volumes iguais de gases é igual à proporção de suas massas molares:
Onde eu 1 - massa de um certo volume do primeiro gás; eu 2 - massa do mesmo volume do segundo gás; M 1 E M 2 - massas molares do primeiro e do segundo gases.
Normalmente, a densidade do gás é determinada em relação ao gás mais leve - hidrogênio (denotado D H2 ). A massa molar do hidrogênio é 2g/mol . Portanto nós conseguimos.
A massa molecular de uma substância no estado gasoso é igual ao dobro da sua densidade de hidrogênio.
Freqüentemente, a densidade de um gás é determinada em relação ao ar (D B ) . Embora o ar seja uma mistura de gases, ainda se fala sobre sua massa molar média. É igual a 29 g/mol. Neste caso, a massa molar é determinada pela expressão M = 29D B .
A determinação das massas moleculares mostrou que as moléculas de gases simples consistem em dois átomos (H2, F2, Cl2, O2 N2) , e moléculas de gases inertes são feitas de um átomo (Ele, Ne, Ar, Kr, Xe, Rn). Para gases nobres, “molécula” e “átomo” são equivalentes.
Lei Boyle-Mariotte:
a uma temperatura constante, o volume de uma determinada quantidade de gás é inversamente proporcional à pressão sob a qual está localizado.Daqui pV = const
,
Onde R
- pressão, V
- volume de gás.
Lei de Gay-Lussac:
a pressão constante e a mudança no volume do gás é diretamente proporcional à temperatura, ou seja,
V/T = const,
Onde T
- temperatura na escala PARA
(Kelvin)
Lei dos gases combinada de Boyle - Mariotte e Gay-Lussac:
pV/T = const.
Esta fórmula é geralmente usada para calcular o volume de um gás sob determinadas condições, se o seu volume sob outras condições for conhecido. Se uma transição for feita de condições normais (ou para condições normais), esta fórmula será escrita da seguinte forma:
pV/T = p
V
/T
,
Onde R
,V
,T
-pressão, volume de gás e temperatura em condições normais ( R
= 101 325 Pa
, T
= 273K
V
=22,4 l/mol)
.
Se a massa e a quantidade de um gás são conhecidas, mas é necessário calcular seu volume, ou vice-versa, utilize Equação de Mendeleev-Clayperon:
Onde n - quantidade de substância gasosa, mol; eu - massa, g; M - massa molar do gás, g/iol ; R - constante universal dos gases. R = 8,31 J/(mol*K)
Leis do gás
Leis do gás. Lei de Avogrado. Volume molar de gás O cientista francês J.L. Gay-Lussac estabeleceu a lei das relações volumétricas: Por exemplo, 1 litro de cloro combina-se com 1 litro de hidrogênio, formando 2
Ao estudar substâncias químicas, conceitos importantes são quantidades como massa molar, densidade de uma substância e volume molar. Então, o que é o volume molar e como ele difere para substâncias em diferentes estados de agregação?
Volume molar: informações gerais
Para calcular o volume molar de uma substância química, é necessário dividir a massa molar dessa substância pela sua densidade. Assim, o volume molar é calculado pela fórmula:
onde Vm é o volume molar da substância, M é a massa molar, p é a densidade. No Sistema Internacional SI, este valor é medido em metro cúbico por mol (m 3 /mol).

Arroz. 1. Fórmula do volume molar.
O volume molar das substâncias gasosas difere das substâncias nos estados líquido e sólido porque um elemento gasoso com uma quantidade de 1 mol ocupa sempre o mesmo volume (se os mesmos parâmetros forem atendidos).
O volume do gás depende da temperatura e da pressão, portanto, ao calcular, deve-se considerar o volume do gás em condições normais. As condições normais são consideradas uma temperatura de 0 graus e uma pressão de 101,325 kPa.
O volume molar de 1 mol de gás em condições normais é sempre o mesmo e igual a 22,41 dm 3 /mol. Este volume é chamado de volume molar de um gás ideal. Ou seja, em 1 mol de qualquer gás (oxigênio, hidrogênio, ar) o volume é 22,41 dm 3 /m.
O volume molar em condições normais pode ser derivado usando a equação de estado para um gás ideal, chamada equação de Clayperon-Mendeleev:
onde R é a constante universal dos gases, R=8,314 J/mol*K=0,0821 l*atm/mol K
Volume de um mol de gás V=RT/P=8,314*273,15/101,325=22,413 l/mol, onde T e P são os valores de temperatura (K) e pressão em condições normais.

Arroz. 2. Tabela de volumes molares.
Lei de Avogrado
Em 1811, A. Avogadro apresentou a hipótese de que volumes iguais de gases diferentes nas mesmas condições (temperatura e pressão) contêm o mesmo número de moléculas. Mais tarde a hipótese foi confirmada e virou lei que leva o nome do grande cientista italiano.

Arroz. 3. Amedeo Avogrado.
A lei fica clara se lembrarmos que na forma gasosa a distância entre as partículas é incomparavelmente maior que o tamanho das próprias partículas.
Assim, as seguintes conclusões podem ser tiradas da lei de Avogadro:
- Volumes iguais de quaisquer gases obtidos à mesma temperatura e à mesma pressão contêm o mesmo número de moléculas.
- 1 mol de gases completamente diferentes nas mesmas condições ocupa o mesmo volume.
- Um mol de qualquer gás em condições normais ocupa um volume de 22,41 litros.
O corolário da lei de Avogadro e o conceito de volume molar baseiam-se no fato de que um mol de qualquer substância contém o mesmo número de partículas (para gases - moléculas), igual à constante de Avogadro.
Para saber o número de mols de soluto contidos em um litro de solução, é necessário determinar a concentração molar da substância usando a fórmula c = n/V, onde n é a quantidade de soluto, expressa em mols, V é o volume da solução, expresso em litros C é a molaridade.
O que aprendemos?
No currículo escolar de química do 8º ano, é estudado o tema “Volume molar”. Um mol de gás contém sempre o mesmo volume, igual a 22,41 metros cúbicos/mol. Este volume é chamado de volume molar do gás.
Teste sobre o tema
Avaliação do relatório
Classificação média: 4.2. Total de avaliações recebidas: 64.
Onde m é massa, M é massa molar, V é volume.
4. Lei de Avogrado. Fundada pelo físico italiano Avogadro em 1811. Volumes idênticos de quaisquer gases, obtidos à mesma temperatura e à mesma pressão, contêm o mesmo número de moléculas.
Assim, podemos formular o conceito de quantidade de uma substância: 1 mol de uma substância contém um número de partículas igual a 6,02 * 10 23 (chamada constante de Avogadro)
A consequência desta lei é que Em condições normais (P 0 =101,3 kPa e T 0 =298 K), 1 mol de qualquer gás ocupa um volume igual a 22,4 litros.
5. Lei Boyle-Mariotte
A temperatura constante, o volume de uma determinada quantidade de gás é inversamente proporcional à pressão sob a qual está localizado:
6. Lei de Gay-Lussac
A pressão constante, a mudança no volume do gás é diretamente proporcional à temperatura:
V/T = const.
7. A relação entre volume de gás, pressão e temperatura pode ser expressa lei combinada de Boyle-Mariotte e Gay-Lussac, que é usado para converter volumes de gás de uma condição para outra:
P 0 , V 0 , T 0 - pressão de volume e temperatura em condições normais: P 0 =760 mm Hg. Arte. ou 101,3 kPa; T 0 =273 K (0 0 C)
8. Avaliação independente do valor molecular massas M pode ser feito usando o chamado equações de estado de gases ideais ou equações de Clapeyron-Mendeleev :
pV=(m/M)*RT=vRT.(1.1)
Onde R - pressão do gás em um sistema fechado, V- volume do sistema, T - massa de gás, T - temperatura absoluta, R- constante universal dos gases.
Observe que o valor da constante R pode ser obtido substituindo valores que caracterizam um mol de gás em condições normais na equação (1.1):
R = (pV)/(T)=(101,325 kPa 22,4 l)/(1 mol 273K)=8,31J/mol.K)
Exemplos de resolução de problemas
Exemplo 1. Trazendo o volume de gás às condições normais.
Que volume (n.s.) será ocupado por 0,4×10 -3 m 3 de gás localizado a 50 0 C e uma pressão de 0,954×10 5 Pa?
Solução. Para trazer o volume de gás às condições normais, use uma fórmula geral que combina as leis de Boyle-Mariotte e Gay-Lussac:
pV/T = p 0 V 0 /T 0 .
O volume do gás (n.s.) é igual a , onde T 0 = 273 K; p 0 = 1,013 × 10 5 Pa; T = 273 + 50 = 323 K;
![]() m 3 = 0,32 × 10 -3 m 3.
m 3 = 0,32 × 10 -3 m 3.
Em (norma) o gás ocupa um volume igual a 0,32×10 -3 m 3 .
Exemplo 2. Cálculo da densidade relativa de um gás a partir do seu peso molecular.
Calcule a densidade do etano C 2 H 6 com base no hidrogênio e no ar.
Solução. Da lei de Avogadro segue-se que a densidade relativa de um gás para outro é igual à razão entre as massas moleculares ( M h) desses gases, ou seja, D=M 1 /M 2. Se M1 C2H6 = 30, M2 H2 = 2, o peso molecular médio do ar é 29, então a densidade relativa do etano em relação ao hidrogênio é D H2 = 30/2 =15.
Densidade relativa do etano no ar: D ar= 30/29 = 1,03, ou seja o etano é 15 vezes mais pesado que o hidrogênio e 1,03 vezes mais pesado que o ar.
Exemplo 3. Determinação do peso molecular médio de uma mistura de gases por densidade relativa.
Calcule o peso molecular médio de uma mistura de gases composta por 80% de metano e 20% de oxigênio (em volume), usando as densidades relativas desses gases em relação ao hidrogênio.
Solução. Muitas vezes os cálculos são feitos de acordo com a regra de mistura, que afirma que a proporção dos volumes de gases em uma mistura de gases de dois componentes é inversamente proporcional às diferenças entre a densidade da mistura e as densidades dos gases que compõem esta mistura . Vamos denotar a densidade relativa da mistura de gases em relação ao hidrogênio por D H2. será maior que a densidade do metano, mas menor que a densidade do oxigênio:
80D H2 – 640 = 320 – 20 D H2; D H2 = 9,6.
A densidade do hidrogênio desta mistura de gases é 9,6. peso molecular médio da mistura gasosa M H2 = 2 D H2 = 9,6×2 = 19,2.
Exemplo 4. Cálculo da massa molar de um gás.
A massa de 0,327×10 -3 m 3 de gás a 13 0 C e uma pressão de 1,040×10 5 Pa é igual a 0,828×10 -3 kg. Calcule a massa molar do gás.
Solução. A massa molar de um gás pode ser calculada usando a equação de Mendeleev-Clapeyron:
Onde eu– massa de gás; M– massa molar do gás; R– constante molar (universal) do gás, cujo valor é determinado pelas unidades de medida aceitas.
Se a pressão for medida em Pa e o volume em m3, então R=8,3144×10 3 J/(kmol×K).
Juntamente com a massa e o volume, os cálculos químicos costumam usar a quantidade de uma substância proporcional ao número de unidades estruturais contidas na substância. Em cada caso, deve-se indicar quais unidades estruturais (moléculas, átomos, íons, etc.) se referem. A unidade de quantidade de uma substância é o mol.
Mol é a quantidade de substância que contém tantas moléculas, átomos, íons, elétrons ou outras unidades estruturais quantos átomos existem em 12 g do isótopo de carbono 12C.
O número de unidades estruturais contidas em 1 mol de uma substância (constante de Avogadro) é determinado com grande precisão; em cálculos práticos é considerado igual a 6,02 1024 mol -1.
Não é difícil mostrar que a massa de 1 mol de uma substância (massa molar), expressa em gramas, é numericamente igual à massa molecular relativa dessa substância.
Assim, o peso molecular relativo (ou, abreviadamente, peso molecular) do cloro livre C1g é 70,90. Portanto, a massa molar do cloro molecular é 70,90 g/mol. No entanto, a massa molar dos átomos de cloro é a metade (45,45 g/mol), uma vez que 1 mol de moléculas de cloro Cl contém 2 moles de átomos de cloro.
De acordo com a lei de Avogadro, volumes iguais de quaisquer gases obtidos à mesma temperatura e à mesma pressão contêm o mesmo número de moléculas. Em outras palavras, o mesmo número de moléculas de qualquer gás ocupa o mesmo volume nas mesmas condições. Ao mesmo tempo, 1 mol de qualquer gás contém o mesmo número de moléculas. Conseqüentemente, nas mesmas condições, 1 mol de qualquer gás ocupa o mesmo volume. Este volume é denominado volume molar do gás e em condições normais (0°C, pressão 101, 425 kPa) é igual a 22,4 litros.
Por exemplo, a afirmação “o teor de dióxido de carbono do ar é 0,04% (vol.)” significa que a uma pressão parcial de CO 2 igual à pressão do ar e à mesma temperatura, o dióxido de carbono contido no ar irá absorver até 0,04% do volume total ocupado pelo ar.
Tarefa de teste
1. Compare o número de moléculas contidas em 1 g de NH 4 e em 1 g de N 2. Em que caso e quantas vezes o número de moléculas é maior?
2. Expresse a massa de uma molécula de dióxido de enxofre em gramas.
4. Quantas moléculas existem em 5,00 ml de cloro em condições padrão?
4. Que volume em condições normais é ocupado por 27 10 21 moléculas de gás?
5. Expresse a massa de uma molécula de NO 2 em gramas -
6. Qual é a proporção dos volumes ocupados por 1 mol de O2 e 1 mol de Oz (as condições são as mesmas)?
7. Massas iguais de oxigênio, hidrogênio e metano são obtidas nas mesmas condições. Encontre a proporção dos volumes de gases retirados.
8. À questão de quanto volume 1 mol de água ocupará em condições normais, a resposta foi: 22,4 litros. Esta é a resposta correta?
9. Expresse a massa de uma molécula de HCl em gramas.
Quantas moléculas de dióxido de carbono existem em 1 litro de ar se o conteúdo volumétrico de CO 2 for 0,04% (condições normais)?
10. Quantos mols estão contidos em 1 m 4 de qualquer gás em condições normais?
11. Expresse em gramas a massa de uma molécula de H 2 O-
12. Quantos mols de oxigênio existem em 1 litro de ar, se o volume
14. Quantos moles de nitrogênio existem em 1 litro de ar se seu conteúdo volumétrico for 78% (condições normais)?
14. Massas iguais de oxigênio, hidrogênio e nitrogênio são obtidas nas mesmas condições. Encontre a proporção dos volumes de gases retirados.
15. Compare o número de moléculas contidas em 1 g de NO 2 e em 1 g de N 2. Em que caso e quantas vezes o número de moléculas é maior?
16. Quantas moléculas estão contidas em 2,00 ml de hidrogênio em condições padrão?
17. Expresse em gramas a massa de uma molécula de H 2 O-
18. Qual é o volume ocupado por 17 10 21 moléculas de gás em condições normais?
TAXA DE REAÇÕES QUÍMICAS
Ao definir o conceito taxa de reação químicaé necessário distinguir entre reações homogêneas e heterogêneas. Se uma reação ocorre em um sistema homogêneo, por exemplo, em uma solução ou em uma mistura de gases, ela ocorre em todo o volume do sistema. Velocidade de reação homogêneaé a quantidade de uma substância que reage ou é formada como resultado de uma reação por unidade de tempo por unidade de volume do sistema. Como a razão entre o número de moles de uma substância e o volume em que ela está distribuída é a concentração molar da substância, a taxa de uma reação homogênea também pode ser definida como mudança na concentração por unidade de tempo de qualquer uma das substâncias: o reagente inicial ou o produto da reação. Para garantir que o resultado do cálculo seja sempre positivo, independentemente de ser baseado em um reagente ou em um produto, utiliza-se o sinal “±” na fórmula:
Dependendo da natureza da reação, o tempo pode ser expresso não apenas em segundos, conforme exigido pelo sistema SI, mas também em minutos ou horas. Durante a reação, a magnitude de sua velocidade não é constante, mas muda continuamente: diminui à medida que as concentrações das substâncias iniciais diminuem. O cálculo acima fornece o valor médio da taxa de reação durante um certo intervalo de tempo Δτ = τ 2 – τ 1. A velocidade verdadeira (instantânea) é definida como o limite para o qual a razão Δ tende COM/ Δτ em Δτ → 0, ou seja, a velocidade verdadeira é igual à derivada da concentração em relação ao tempo.
Para uma reação cuja equação contém coeficientes estequiométricos diferentes da unidade, os valores das taxas expressos para diferentes substâncias não são os mesmos. Por exemplo, para a reação A + 4B = D + 2E, o consumo da substância A é de um mol, o da substância B é de três mols e o fornecimento da substância E é de dois mols. É por isso υ (UMA) = ⅓ υ (B) = υ (D) =½ υ (E) ou υ (E). = ⅔ υ (EM) .
Se ocorrer uma reação entre substâncias localizadas em diferentes fases de um sistema heterogêneo, ela só poderá ocorrer na interface entre essas fases. Por exemplo, a interação entre uma solução ácida e um pedaço de metal ocorre apenas na superfície do metal. Velocidade de reação heterogêneaé a quantidade de uma substância que reage ou é formada como resultado de uma reação por unidade de tempo por unidade de superfície de interface:
 .
.
A dependência da taxa de uma reação química na concentração de reagentes é expressa pela lei da ação das massas: a uma temperatura constante, a taxa de uma reação química é diretamente proporcional ao produto das concentrações molares das substâncias reagentes elevadas a potências iguais aos coeficientes nas fórmulas dessas substâncias na equação de reação. Então para a reação
2A + B → produtos
a proporção é válida υ ~ · COM Um 2 · COM B, e para a transição para a igualdade é introduzido um coeficiente de proporcionalidade k, chamado constante de taxa de reação:
υ = k· COM Um 2 · COM B = k·[A]2 ·[B]
(as concentrações molares nas fórmulas podem ser indicadas pela letra COM com o índice correspondente e a fórmula da substância entre colchetes). O significado físico da constante de taxa de reação é a taxa de reação em concentrações de todos os reagentes iguais a 1 mol/l. A dimensão da constante de velocidade de reação depende do número de fatores no lado direito da equação e pode ser c –1; s –1 ·(l/mol); s –1 · (l 2 /mol 2), etc., ou seja, tal que em qualquer caso, nos cálculos, a taxa de reação é expressa em mol · l –1 · s –1.
Para reações heterogêneas, a equação da lei da ação das massas inclui as concentrações apenas das substâncias que estão na fase gasosa ou em solução. A concentração de uma substância na fase sólida é um valor constante e está incluída na constante de velocidade, por exemplo, para o processo de combustão do carvão C + O 2 = CO 2, a lei da ação das massas está escrita:
υ = ok, eu·const··= k·,
Onde k= ok, eu const.
Em sistemas onde uma ou mais substâncias são gases, a taxa de reação também depende da pressão. Por exemplo, quando o hidrogênio interage com o vapor de iodo H 2 + I 2 = 2HI, a taxa da reação química será determinada pela expressão:
υ = k··.
Se aumentarmos a pressão, por exemplo, em 4 vezes, o volume ocupado pelo sistema diminuirá na mesma proporção e, conseqüentemente, as concentrações de cada uma das substâncias reagentes aumentarão na mesma proporção. A taxa de reação neste caso aumentará 9 vezes
Dependência da taxa de reação da temperatura descrito pela regra de van't Hoff: a cada aumento de 10 graus na temperatura, a taxa de reação aumenta de 2 a 4 vezes. Isto significa que à medida que a temperatura aumenta numa progressão aritmética, a taxa de uma reação química aumenta exponencialmente. A base da fórmula de progressão é coeficiente de temperatura da taxa de reaçãoγ, mostrando quantas vezes a taxa de uma determinada reação aumenta (ou, o que é a mesma coisa, a constante de velocidade) com um aumento na temperatura em 10 graus. Matematicamente, a regra de Van't Hoff é expressa pelas fórmulas:
 ou
ou 
onde e são as taxas de reação, respectivamente, no início t 1 e último t 2 temperaturas. A regra de Van't Hoff também pode ser expressa pelas seguintes relações:
![]() ;
;  ;
; ![]() ;
;  ,
,
onde e são, respectivamente, a taxa e a constante de velocidade da reação à temperatura t; e – os mesmos valores em temperatura t +10n; n– número de intervalos de “dez graus” ( n =(t 2 –t 1)/10), pelo qual a temperatura mudou (pode ser um número inteiro ou fracionário, positivo ou negativo).
Tarefa de teste
1. Encontre o valor da constante de velocidade para a reação A + B -> AB, se em concentrações das substâncias A e B iguais a 0,05 e 0,01 mol/l, respectivamente, a taxa de reação é 5 10 -5 mol/(l -min).
2. Quantas vezes a taxa de reação 2A + B -> A2B mudará se a concentração da substância A aumentar 2 vezes e a concentração da substância B diminuir 2 vezes?
4. Quantas vezes a concentração da substância B 2 no sistema 2A 2 (g) + B 2 (g) = 2A 2 B (g) deve ser aumentada para que quando a concentração da substância A diminua em 4 vezes , a taxa da reação direta não muda?
4. Algum tempo após o início da reação 3A+B->2C+D, as concentrações das substâncias eram: [A] =0,04 mol/l; [B] = 0,01 mol/l; [C] =0,008 mol/l. Quais são as concentrações iniciais das substâncias A e B?
5. No sistema CO + C1 2 = COC1 2, a concentração foi aumentada de 0,04 para 0,12 mol/l, e a concentração de cloro foi aumentada de 0,02 para 0,06 mol/l. Quantas vezes a taxa da reação direta aumentou?
6. A reação entre as substâncias A e B é expressa pela equação: A + 2B → C. As concentrações iniciais são: [A] 0 = 0,04 mol/l, [B] o = 0,05 mol/l. A constante de taxa de reação é 0,4. Encontre a taxa de reação inicial e a taxa de reação após algum tempo, quando a concentração da substância A diminui em 0,01 mol/l.
7. Como a taxa da reação 2CO + O2 = 2CO2, que ocorre em um recipiente fechado, mudará se a pressão for duplicada?
8. Calcule quantas vezes a taxa de reação aumentará se a temperatura do sistema aumentar de 20 °C para 100 °C, tomando o valor do coeficiente de temperatura da taxa de reação igual a 4.
9. Como a taxa de reação 2NO(r.) + 0 2 (g.) → 2N02(r.) mudará se a pressão no sistema for aumentada em 4 vezes;
10. Como a taxa de reação 2NO(r.) + 0 2 (g.) → 2N02(r.) mudará se o volume do sistema for reduzido em 4 vezes?
11. Como a taxa da reação 2NO(r.) + 0 2 (g.) → 2N02(r.) mudará se a concentração de NO for aumentada em 4 vezes?
12. Qual é o coeficiente de temperatura da taxa de reação se, com um aumento de 40 graus na temperatura, a taxa de reação
aumenta 15,6 vezes?
14. . Encontre o valor da constante de velocidade para a reação A + B -> AB, se em concentrações das substâncias A e B iguais a 0,07 e 0,09 mol/l, respectivamente, a taxa de reação é 2,7 · 10 -5 mol/(l-min ).
14. A reação entre as substâncias A e B é expressa pela equação: A + 2B → C. As concentrações iniciais são: [A] 0 = 0,01 mol/l, [B] o = 0,04 mol/l. A constante de taxa de reação é 0,5. Encontre a taxa de reação inicial e a taxa de reação após algum tempo, quando a concentração da substância A diminui em 0,01 mol/l.
15. Como a taxa de reação 2NO(r.) + 0 2 (g.) → 2N02(r.) mudará se a pressão no sistema for duplicada;
16. No sistema CO + C1 2 = COC1 2, a concentração foi aumentada de 0,05 para 0,1 mol/l, e a concentração de cloro foi aumentada de 0,04 para 0,06 mol/l. Quantas vezes a taxa da reação direta aumentou?
17. Calcule quantas vezes a taxa de reação aumentará se a temperatura do sistema aumentar de 20 °C para 80 °C, tomando o valor do coeficiente de temperatura da taxa de reação igual a 2.
18. Calcule quantas vezes a taxa de reação aumentará se a temperatura do sistema aumentar de 40 °C para 90 °C, tomando o valor do coeficiente de temperatura da taxa de reação igual a 4.
LIGAÇÃO QUÍMICA. FORMAÇÃO E ESTRUTURA DE MOLÉCULAS
1.Que tipos de ligações químicas você conhece? Dê um exemplo da formação de uma ligação iônica usando o método da ligação de valência.
2. Qual ligação química é chamada de covalente? O que é característico do tipo de ligação covalente?
4. Quais propriedades são caracterizadas por uma ligação covalente? Mostre isso com exemplos específicos.
4. Que tipo de ligação química existe nas moléculas de H2; Cl2HC1?
5.Qual é a natureza das ligações nas moléculas? NCI 4 CS2, CO2? Indique para cada um deles a direção do deslocamento do par de elétrons comum.
6. Qual ligação química é chamada de iônica? O que é característico do tipo de ligação iônica?
7. Que tipo de ligação existe nas moléculas de NaCl, N 2, Cl 2?
8. Desenhe todas as formas possíveis de sobreposição do orbital s com o orbital p;. Indique a direção da comunicação neste caso.
9. Explique o mecanismo doador-aceitador das ligações covalentes usando o exemplo da formação do íon fosfônio [PH 4 ]+.
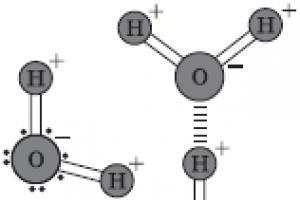
10. Nas moléculas de CO, C0 2, a ligação é polar ou apolar? Explicar. Descreva a ligação de hidrogênio.
11. Por que algumas moléculas que possuem ligações polares são geralmente apolares?
12. O tipo de ligação covalente ou iônica é típico dos seguintes compostos: Nal, S0 2, KF? Por que uma ligação iônica é um caso extremo de ligação covalente?
14. O que é uma ligação metálica? Como é diferente de uma ligação covalente? Que propriedades dos metais ele determina?
14. Qual é a natureza das ligações entre os átomos nas moléculas; KHF 2, H 2 0, HNO ?
15. Como podemos explicar a alta força de ligação entre os átomos na molécula de nitrogênio N2 e a força significativamente menor na molécula de fósforo P4?
16. Que tipo de ligação é chamada de ligação de hidrogênio? Por que a formação de ligações de hidrogênio não é típica para moléculas de H2S e HC1, ao contrário de H2O e HF?
17. Qual ligação é chamada de iônica? Uma ligação iônica tem propriedades de saturação e direcionalidade? Por que é um caso extremo de ligação covalente?
18. Que tipo de ligação existe nas moléculas NaCl, N 2, Cl 2?