Ilość substancji, mol, masa molowa i objętość molowa. Wyznaczanie objętości molowej gazów
Masę 1 mola substancji nazywa się molową. Jak nazywa się objętość 1 mola substancji? Oczywiście nazywa się to również objętością molową.
Jaka jest objętość molowa wody? Kiedy odmierzaliśmy 1 mol wody, nie zważyliśmy na wadze 18 g wody – jest to niewygodne. Użyliśmy przyborów miarowych: cylindra lub zlewki, ponieważ wiedzieliśmy, że gęstość wody wynosi 1 g/ml. Dlatego objętość molowa wody wynosi 18 ml/mol. W przypadku cieczy i ciał stałych objętość molowa zależy od ich gęstości (ryc. 52, a). Inaczej jest w przypadku gazów (ryc. 52, b).
Ryż. 52.
Objętości molowe (n.s.):
a - ciecze i ciała stałe; b - substancje gazowe
Jeśli weźmiemy 1 mol wodoru H2 (2 g), 1 mol tlenu O2 (32 g), 1 mol ozonu O3 (48 g), 1 mol dwutlenku węgla CO2 (44 g), a nawet 1 mol pary wodnej H2O (18 g) w tych samych warunkach, na przykład normalnych (w chemii zwyczajowo nazywa się warunki normalne (n.s.) temperaturą 0 ° C i ciśnieniem 760 mm Hg, czyli 101,3 kPa), wtedy się okazuje że 1 mol dowolnego gazu zajmie tę samą objętość, równą 22,4 litra, i będzie zawierał tę samą liczbę cząsteczek - 6 × 10 23.
A jeśli weźmiesz 44,8 litra gazu, to ile jego substancji zostanie pobrane? Oczywiście 2 mole, ponieważ podana objętość jest dwukrotnie większa od objętości molowej. Stąd:
gdzie V jest objętością gazu. Stąd
Objętość molowa jest wielkością fizyczną równą stosunkowi objętości substancji do ilości substancji.
Objętość molowa substancji gazowych wyrażana jest w l/mol. Vm - 22,4 l/mol. Objętość jednego kilomola nazywana jest kilomolem i mierzy się ją w m 3 /kmol (Vm = 22,4 m 3 /kmol). Odpowiednio objętość milimolowa wynosi 22,4 ml/mmol.
Zadanie 1. Znajdź masę 33,6 m 3 amoniaku NH 3 (n.s.).

Zadanie 2. Znajdź masę i objętość (n.v.) 18 × 10 20 cząsteczek siarkowodoru H 2 S.
Rozwiązując zadanie, zwróćmy uwagę na liczbę cząsteczek 18 × 10 20. Ponieważ 10 20 jest 1000 razy mniejsze niż 10 23, oczywiście obliczenia należy przeprowadzić stosując mmol, ml/mmol i mg/mmol.

Słowa i wyrażenia kluczowe
- Objętości molowe, milimolowe i kilomolowe gazów.
- Objętość molowa gazów (w normalnych warunkach) wynosi 22,4 l/mol.
- Normalne warunki.
Pracuj z komputerem
- Zapoznaj się z wnioskiem elektronicznym. Zapoznaj się z materiałem lekcyjnym i wykonaj przydzielone zadania.
- Znajdź w Internecie adresy e-mail, które mogą posłużyć jako dodatkowe źródła ujawniające treść słów kluczowych i wyrażeń występujących w akapicie. Zaoferuj nauczycielowi pomoc w przygotowaniu nowej lekcji - sporządź raport na temat kluczowych słów i zwrotów z następnego akapitu.
Pytania i zadania
- Znajdź masę i liczbę cząsteczek w n. ty na: a) 11,2 litra tlenu; b) 5,6 m 3 azotu; c) 22,4 ml chloru.
- Znajdź objętość, która przy n. ty zajmie: a) 3 g wodoru; b) 96 kg ozonu; c) 12 × 10 20 cząsteczek azotu.
- Znajdź gęstość (masa 1 litra) argonu, chloru, tlenu i ozonu w temperaturze pokojowej. ty Ile cząsteczek każdej substancji zmieści się w 1 litrze w tych samych warunkach?
- Oblicz masę 5 litrów (n.s.): a) tlen; b) ozon; c) dwutlenek węgla CO2.
- Wskaż, co jest cięższe: a) 5 litrów dwutlenku siarki (SO 2) lub 5 litrów dwutlenku węgla (CO 2); b) 2 litry dwutlenku węgla (CO 2) lub 3 litry tlenku węgla (CO).
Z zapisów, że na jeden mol jakiejkolwiek substancji przypada liczba cząstek tej substancji równa liczbie Avogadro oraz że w jednakowych objętościach tych gazów zawarta jest równa liczba cząstek różnych gazów, znajdujących się w tych samych warunkach fizycznych, wynika, co następuje:
równe ilości dowolnych substancji gazowych w tych samych warunkach fizycznych zajmują równe objętości
Na przykład objętość jednego mola dowolnego gazu ma (at p, T = stała) to samo znaczenie. W związku z tym równanie reakcji zachodzącej z udziałem gazów określa nie tylko stosunek ich ilości i mas, ale także ich objętości.
objętość molowa gazu (V M) to objętość gazu zawierająca 1 mol cząstek tego gazu
V M = V / n
Jednostką objętości molowej gazu w układzie SI jest metr sześcienny na mol (m 3 /mol), ale częściej stosuje się jednostki podwielokrotne - litr (decymetr sześcienny) na mol (l/mol, dm 3 /mol) i mililitr (sześcienny). centymetr) na mol (cm3/mol).
Zgodnie z definicją objętości molowej dowolnego gazu, stosunek jego objętości V do ilości N będzie taki sam, pod warunkiem, że jest to gaz doskonały.
W normalnych warunkach (norma) - 101,3 kPa, 0°C - objętość molowa gazu doskonałego jest równa
V M = 2,241381·10 -2 m 3 /mol ≈ 22,4 l/mol
W obliczeniach chemicznych stosuje się zaokrągloną wartość 22,4 l/mol, ponieważ dokładna wartość odnosi się do gazu doskonałego, a większość gazów rzeczywistych różni się od niego właściwościami. Gazy rzeczywiste o bardzo niskiej temperaturze równowagowej kondensacji (H 2, O 2, N 2) w normalnych warunkach mają objętość prawie równą 22,4 l/mol, a gazy skraplające się w wysokich temperaturach mają nieco mniejszą objętość molową przy n. r.: dla CO 2 - 22,26 l/mol, dla NH 3 - 22,08 l/mol.
Znając objętość określonego gazu w danych warunkach, można określić ilość substancji w tej objętości i odwrotnie, na podstawie ilości substancji zawartej w danej porcji gazu można znaleźć objętość tej porcji:
n = V / V M ; V = V M * rz
Objętość molowa gazu w N.S. jest podstawową stałą fizyczną powszechnie stosowaną w obliczeniach chemicznych. Pozwala na wykorzystanie objętości gazu zamiast jego masy, co jest bardzo wygodne w chemii analitycznej (analizatory gazów bazujące na pomiarze objętości), gdyż łatwiej jest zmierzyć objętość gazu niż jego masę.
Wartość objętości molowej gazu przy nr. jest współczynnikiem proporcjonalności między stałymi Avogadra i Loschmidta:
V M = N A / N L = 6,022 10 23 (mol -1) / 2,24 10 4 (cm 3 /mol) = 2,69 10 19 (cm -3)
Korzystając z objętości molowej i masy molowej gazu, można wyznaczyć gęstość gazu:
ρ = M / V M
W obliczeniach opartych na prawie równoważników substancji gazowych (odczynników, produktów) zamiast masy równoważnej wygodniej jest stosować objętość równoważną, czyli stosunek objętości porcji danego gazu do objętości równoważnej ilość substancji w tej porcji:
V eq = V / n eq = V / zn = V M / z; (p, T = stała)
Równoważna jednostka objętości jest taka sama jak jednostka objętości molowej. Wartość równoważnej objętości gazu jest stałą danego gazu tylko w określonej reakcji, gdyż zależy od współczynnika równoważności f równ.
Objętość molowa gazu
Objętość molowa gazu Z zapisów, że w jednym molu dowolnej substancji znajduje się liczba cząstek tej substancji równa liczbie Avogadra oraz równa liczba cząstek różnych gazów jednocześnie
Objętość gazu w normalnych warunkach
Temat 1
LEKCJA 7
Temat. Objętość molowa gazów. Obliczanie objętości gazu w warunkach normalnych
Cele zajęć: zapoznanie studentów z pojęciem „objętość molowa”; ujawnić cechy stosowania pojęcia „objętości molowej” dla substancji gazowych; nauczyć studentów wykorzystania zdobytej wiedzy do obliczania objętości gazów w warunkach normalnych.
Rodzaj lekcji: łączony.
Formy pracy: historia nauczyciela, praktyka kierowana.
Wyposażenie: Układ okresowy pierwiastków chemicznych D.I. Mendelejewa, karty zadań, sześcian o pojemności 22,4 l (o boku 28,2 cm).
II. Sprawdzanie zadań domowych, aktualizacja podstawowej wiedzy
Studenci przesyłają wykonane prace domowe na arkuszach do weryfikacji.
1) Co to jest „ilość substancji”?
2) Jednostka miary ilości substancji.
3) Ile cząstek mieści się w 1 molu substancji?
4) Jaka jest zależność pomiędzy ilością substancji a stanem skupienia, w jakim ta substancja się znajduje?
5) Ile cząsteczek wody znajduje się w 1 molu lodu?
6) A co z 1 molem ciekłej wody?
7) W 1 molu pary wodnej?
8) Jaką masę będą miały:
III. Nauka nowego materiału
Tworzenie i rozwiązywanie sytuacji problemowej Pytanie problematyczne. Jaką objętość zajmie:
Na te pytania nie możemy od razu odpowiedzieć, ponieważ objętość substancji zależy od jej gęstości. I zgodnie ze wzorem V = m / ρ objętość będzie inna. 1 mol pary zajmuje większą objętość niż 1 mol wody lub lodu.
Ponieważ w substancjach ciekłych i gazowych odległość między cząsteczkami wody jest inna.
Wielu naukowców badało substancje gazowe. Znaczący wkład w badania tego zagadnienia wnieśli francuski chemik Joseph Louis Gay-Lussac i angielski fizyk Robert Boyle, którzy sformułowali szereg praw fizycznych opisujących stan gazów.
Czy znasz te wzory?
Wszystkie gazy są jednakowo sprężone i mają ten sam współczynnik rozszerzalności cieplnej. Objętość gazów nie zależy od wielkości poszczególnych cząsteczek, ale od odległości między cząsteczkami. Odległości między cząsteczkami zależą od ich prędkości ruchu, energii i odpowiednio temperatury.
Na podstawie tych praw i swoich badań włoski naukowiec Amedeo Avogadro sformułował prawo:
Równe objętości różnych gazów zawierają tę samą liczbę cząsteczek.
W normalnych warunkach substancje gazowe mają strukturę molekularną. Cząsteczki gazu są bardzo małe w porównaniu z odległością między nimi. Dlatego o objętości gazu nie decyduje wielkość cząstek (cząsteczek), ale odległość między nimi, która jest w przybliżeniu taka sama dla każdego gazu.
A. Avogadro doszedł do wniosku, że jeśli weźmiemy 1 mol, czyli 6,02 x 1023 cząsteczek dowolnego gazu, zajmą one tę samą objętość. Ale jednocześnie objętość tę mierzy się w tych samych warunkach, to znaczy w tej samej temperaturze i ciśnieniu.
Warunki, w jakich przeprowadzane są takie obliczenia, nazywane są warunkami normalnymi.
Warunki normalne (n.v.):
T = 273 K lub t = 0 °C
P = 101,3 kPa lub P = 1 atm. = 760 mm Hg. Sztuka.
Objętość 1 mola substancji nazywa się objętością molową (Vm). Dla gazów w normalnych warunkach wynosi 22,4 l/mol.
Pokazano sześcian o objętości 22,4 litra.
Taka kostka zawiera 6,02-1023 cząsteczek dowolnych gazów, na przykład tlenu, wodoru, amoniaku (NH3), metanu (CH4).
Pod jakimi warunkami?
W temperaturze 0°C i ciśnieniu 760 mm Hg. Sztuka.
Z prawa Avogadro wynika, że
gdzie Vm = 22,4 l/mol dowolnego gazu w n. V.
Znając objętość gazu, możesz obliczyć ilość substancji i odwrotnie.
IV. Kształtowanie umiejętności i zdolności
Ćwicz na przykładach
Oblicz, jaką objętość zajmą 3 mole tlenu w N. V.
Oblicz liczbę cząsteczek tlenku węgla(IV) w objętości 44,8 litra (n.v.).
2) Oblicz liczbę cząsteczek C O 2, korzystając ze wzorów:
N (CO 2) = 2 mol · 6,02 · 1023 cząsteczki/mol = 12,04 · 1023 cząsteczki.
Odpowiedź: 12,04 · 1023 cząsteczki.
Oblicz objętość zajmowaną przez azot o masie 112 g (obecnie).
V (N 2) = 4 mol · 22,4 l/mol = 89,6 l.
V. Praca domowa
Przeanalizuj odpowiedni akapit podręcznika i odpowiedz na pytania.
Zadanie twórcze (praktyka domowa). Rozwiąż samodzielnie zadania 2, 4, 6 z mapy.
Zadanie kartkowe na lekcję 7
Oblicz, jaką objętość zajmie 7 moli azotu N2 (w oparciu o prąd).
Oblicz liczbę cząsteczek wodoru w objętości 112 litrów.
(Odpowiedź: 30,1 1023 cząsteczek)
Oblicz objętość siarkowodoru o masie 340 g.
Objętość gazu w normalnych warunkach
Objętość molowa gazów. Obliczanie objętości gazu w warunkach normalnych - ILOŚĆ SUBSTANCJI. OBLICZENIA WEDŁUG WZORÓW CHEMICZNYCH – WSZYSTKIE LEKCJE CHEMII – 8 klasa – notatki z lekcji – lekcje chemii – Scenariusz lekcji – Notatki z lekcji – Scenariusze lekcji – opracowanie lekcji chemii – CHEMIA – Program szkolny na poziomie standardowym i akademickim – wszystkie lekcje chemii dla klasy ósmej 12- letnie szkoły
Przepisy gazowe. Prawo Avogadra. Objętość molowa gazu
Francuski naukowiec J.L. Gay-Lussac ustanowił prawo relacje objętościowe:
Na przykład, 1 litr chloru łączy się z 1 litr wodoru , tworząc 2 litry chlorowodoru ; 2 l tlenek siarki (IV) połączyć się z Z 1 litra tlenu powstaje 1 litr tlenku siarki (VI).
Prawo to pozwoliło włoskiemu naukowcowi A. Avogadro zakładamy, że cząsteczki prostych gazów ( wodór, tlen, azot, chlor itp.
) składać się z dwa identyczne atomy
. Kiedy wodór łączy się z chlorem, ich cząsteczki rozpadają się na atomy, a te ostatnie tworzą cząsteczki chlorowodoru. Ponieważ jednak z jednej cząsteczki wodoru i jednej cząsteczki chloru powstają dwie cząsteczki chlorowodoru, objętość tej ostatniej musi być równa sumie objętości pierwotnych gazów.
Zatem relacje objętościowe można łatwo wyjaśnić, jeśli wyjdziemy z idei dwuatomowej natury cząsteczek prostych gazów ( H2, Cl2, O2, N2 itp.
) - To z kolei służy jako dowód dwuatomowej natury cząsteczek tych substancji.
Badanie właściwości gazów pozwoliło A. Avogadro postawić hipotezę, która została następnie potwierdzona danymi eksperymentalnymi i dlatego stała się znana jako prawo Avogadra:
Prawo Avogadra implikuje ważną kwestię konsekwencja: w tych samych warunkach 1 mol dowolnego gazu zajmuje tę samą objętość.
Objętość tę można obliczyć, jeśli znana jest masa 1 l gaz W normalnych warunkach (n.s.), tj. w temperaturze 273К (О°С) i ciśnienie 101 325 Pa (760 mmHg) , masa 1 litra wodoru wynosi 0,09 g, jego masa molowa wynosi 1,008 · 2 = 2,016 g/mol. Następnie objętość zajmowana przez 1 mol wodoru w normalnych warunkach jest równa 22,4 l
W tych samych warunkach masa 1l tlen 1,492g ; molowy 32 g/mol . Wtedy objętość tlenu w (n.s.) jest również równa 22,4 mola
Objętość molowa gazu to stosunek objętości substancji do ilości tej substancji:
Gdzie V M - objętość molowa gazu (wymiar l/mol ); V jest objętością substancji układu; N - ilość substancji w układzie. Przykładowy wpis: V M gaz (Dobrze.) =22,4 l/mol.
Na podstawie prawa Avogadra wyznacza się masy molowe substancji gazowych. Im większa masa cząsteczek gazu, tym większa masa tej samej objętości gazu. Równe objętości gazów w tych samych warunkach zawierają tę samą liczbę cząsteczek, a zatem moli gazów. Stosunek mas równych objętości gazów jest równy stosunkowi ich mas molowych:
Gdzie M 1 - masa określonej objętości pierwszego gazu; M 2 - masa tej samej objętości drugiego gazu; M 1 I M 2 - masy molowe pierwszego i drugiego gazu.
Zazwyczaj gęstość gazu określa się w odniesieniu do najlżejszego gazu – wodoru (oznaczonego jako D H2 ). Masa molowa wodoru wynosi 2 g/mol . Dlatego otrzymujemy.
Masa cząsteczkowa substancji w stanie gazowym jest równa dwukrotności jej gęstości wodoru.
Często gęstość gazu określa się w stosunku do powietrza (D B ) . Chociaż powietrze jest mieszaniną gazów, nadal mówi się o jego średniej masie molowej. Jest to równe 29 g/mol. W tym przypadku masę molową określa się na podstawie wyrażenia M = 29D B .
Wyznaczenie mas cząsteczkowych wykazało, że cząsteczki prostych gazów składają się z dwóch atomów (H2, F2, Cl2, O2 N2) , a cząsteczki gazów obojętnych składają się z jednego atomu (He, Ne, Ar, Kr, Xe, Rn). W przypadku gazów szlachetnych „cząsteczka” i „atom” są równoważne.
Prawo Boyle’a-Mariotte’a:
w stałej temperaturze objętość danej ilości gazu jest odwrotnie proporcjonalna do ciśnienia, pod jakim się ona znajduje.Stąd pV = stała
,
Gdzie R
- ciśnienie, V
- objętość gazu.
Prawo Gay-Lussaca:
przy stałym ciśnieniu, a zmiana objętości gazu jest wprost proporcjonalna do temperatury, tj.
V/T = stała,
Gdzie T
- temperatura na skali DO
(kelwin)
Połączone prawo gazowe Boyle'a - Mariotte'a i Gay-Lussaca:
pV/T = stała
Wzór ten jest zwykle używany do obliczenia objętości gazu w danych warunkach, jeśli znana jest jego objętość w innych warunkach. Jeśli dokonano przejścia z warunków normalnych (lub do warunków normalnych), wówczas wzór ten zapisuje się w następujący sposób:
pV/T = p
V
/T
,
Gdzie R
, V
,T
-ciśnienie, objętość gazu i temperatura w normalnych warunkach ( R
= 101 325 Pa
, T
= 273 tys
V
=22,4 l/mol)
.
Jeżeli znana jest masa i ilość gazu, ale konieczne jest obliczenie jego objętości, lub odwrotnie, należy zastosować Równanie Mendelejewa-Clayperona:
Gdzie N - ilość substancji gazowej, mol; M - masa, g; M - masa molowa gazu, g/iol ; R - uniwersalna stała gazowa. R = 8,31 J/(mol*K)
Przepisy gazowe
Przepisy gazowe. Prawo Avogadra. Objętość molowa gazu Francuski naukowiec J.L. Gay-Lussac ustalił prawo stosunków objętościowych: na przykład 1 litr chloru łączy się z 1 litrem wodoru, tworząc 2
Podczas badania substancji chemicznych ważnymi pojęciami są takie wielkości, jak masa molowa, gęstość substancji i objętość molowa. Czym zatem jest objętość molowa i czym się ona różni dla substancji w różnych stanach skupienia?
Objętość molowa: informacje ogólne
Aby obliczyć objętość molową substancji chemicznej, należy podzielić masę molową tej substancji przez jej gęstość. Zatem objętość molową oblicza się według wzoru:
gdzie Vm to objętość molowa substancji, M to masa molowa, p to gęstość. W międzynarodowym układzie SI wartość tę mierzy się w metrach sześciennych na mol (m 3 /mol).

Ryż. 1. Wzór na objętość molową.
Objętość molowa substancji gazowych różni się od substancji w stanie ciekłym i stałym tym, że pierwiastek gazowy w ilości 1 mola zajmuje zawsze tę samą objętość (o ile spełnione są te same parametry).
Objętość gazu zależy od temperatury i ciśnienia, dlatego przy obliczaniu należy przyjąć objętość gazu w normalnych warunkach. Za normalne warunki uważa się temperaturę 0 stopni i ciśnienie 101,325 kPa.
Objętość molowa 1 mola gazu w normalnych warunkach jest zawsze taka sama i równa 22,41 dm 3 /mol. Objętość ta nazywana jest objętością molową gazu doskonałego. Oznacza to, że w 1 molu dowolnego gazu (tlenu, wodoru, powietrza) objętość wynosi 22,41 dm 3 /m.
Objętość molową w warunkach normalnych można wyznaczyć za pomocą równania stanu gazu doskonałego, zwanego równaniem Clayperona-Mendelejewa:
gdzie R jest uniwersalną stałą gazową, R=8,314 J/mol*K=0,0821 l*atm/mol K
Objętość jednego mola gazu V=RT/P=8,314*273,15/101,325=22,413 l/mol, gdzie T i P to wartość temperatury (K) i ciśnienia w warunkach normalnych.

Ryż. 2. Tabela objętości molowych.
Prawo Avogadro
W 1811 r. A. Avogadro wysunął hipotezę, że równe objętości różnych gazów w tych samych warunkach (temperatura i ciśnienie) zawierają tę samą liczbę cząsteczek. Później hipoteza została potwierdzona i stała się prawem noszącym imię wielkiego włoskiego naukowca.

Ryż. 3. Amedeo Avogadro.
Prawo stanie się jasne, jeśli przypomnimy sobie, że w postaci gazowej odległość między cząsteczkami jest nieporównywalnie większa niż wielkość samych cząstek.
Zatem z prawa Avogadra można wyciągnąć następujące wnioski:
- Równe objętości dowolnych gazów pobranych w tej samej temperaturze i pod tym samym ciśnieniem zawierają tę samą liczbę cząsteczek.
- 1 mol zupełnie różnych gazów w tych samych warunkach zajmuje tę samą objętość.
- Jeden mol dowolnego gazu w normalnych warunkach zajmuje objętość 22,41 litra.
Konsekwencje prawa Avogadra i koncepcja objętości molowej opierają się na fakcie, że mol dowolnej substancji zawiera taką samą liczbę cząstek (dla gazów - cząsteczek), równą stałej Avogadro.
Aby dowiedzieć się, ile moli substancji rozpuszczonej znajduje się w jednym litrze roztworu, należy wyznaczyć stężenie molowe substancji ze wzoru c = n/V, gdzie n to ilość substancji rozpuszczonej wyrażona w molach, V to objętość roztworu wyrażona w litrach C to molarność.
Czego się nauczyliśmy?
W programie nauczania chemii w ósmej klasie realizowany jest temat „Objętość molowa”. Jeden mol gazu zawsze zawiera tę samą objętość, równą 22,41 metra sześciennego/mol. Objętość ta nazywana jest objętością molową gazu.
Testuj w temacie
Ocena raportu
Średnia ocena: 4.2. Łączna liczba otrzymanych ocen: 64.
Gdzie m to masa, M to masa molowa, V to objętość.
4. Prawo Avogadra. Założona przez włoskiego fizyka Avogadro w 1811 roku. Identyczne objętości dowolnych gazów, pobrane w tej samej temperaturze i pod tym samym ciśnieniem, zawierają tę samą liczbę cząsteczek.
W ten sposób możemy sformułować pojęcie ilości substancji: 1 mol substancji zawiera liczbę cząstek równą 6,02 * 10 23 (zwaną stałą Avogadra)
Konsekwencją tego prawa jest to W normalnych warunkach (P 0 =101,3 kPa i T 0 =298 K) 1 mol dowolnego gazu zajmuje objętość równą 22,4 litra.
5. Prawo Boyle’a-Mariotte’a
W stałej temperaturze objętość danej ilości gazu jest odwrotnie proporcjonalna do ciśnienia, pod jakim się ona znajduje:
6. Prawo Gay-Lussaca
Przy stałym ciśnieniu zmiana objętości gazu jest wprost proporcjonalna do temperatury:
V/T = stała
7. Można wyrazić związek pomiędzy objętością gazu, ciśnieniem i temperaturą połączone prawo Boyle’a-Mariotte’a i Gay-Lussaca, który służy do przeliczania objętości gazu z jednego stanu na drugi:
P 0 , V 0 , T 0 - ciśnienie objętości i temperatury w normalnych warunkach: P 0 =760 mm Hg. Sztuka. lub 101,3 kPa; T 0 =273 K (0 0 C)
8. Niezależna ocena wartości molekularnej szerokie rzesze M można to zrobić za pomocą tzw Równania stanu gazu doskonałego lub równania Clapeyrona-Mendelejewa :
pV=(m/M)*RT=vRT.(1.1)
Gdzie R - ciśnienie gazu w układzie zamkniętym, V- objętość układu, T - masa gazowa, T - temperatura absolutna, R- uniwersalna stała gazowa.
Należy pamiętać, że wartość stałej R można otrzymać podstawiając wartości charakteryzujące jeden mol gazu w warunkach normalnych do równania (1.1):
R = (pV)/(T)=(101,325 kPa 22,4 l)/(1 mol 273 K) = 8,31 J/mol.K)
Przykłady rozwiązywania problemów
Przykład 1. Doprowadzenie objętości gazu do normalnych warunków.
Jaką objętość (nr) zajmie 0,4×10 -3 m 3 gazu znajdującego się w temperaturze 50 0 C i pod ciśnieniem 0,954×10 5 Pa?
Rozwiązanie. Aby doprowadzić objętość gazu do normalnych warunków, użyj ogólnego wzoru łączącego prawa Boyle'a-Mariotte'a i Gay-Lussaca:
pV/T = p 0 V 0 /T 0 .
Objętość gazu (n.s.) jest równa , gdzie T 0 = 273 K; p 0 = 1,013 × 10 5 Pa; T = 273 + 50 = 323 K;
![]() m 3 = 0,32 × 10 -3 m 3.
m 3 = 0,32 × 10 -3 m 3.
W (norma) gaz zajmuje objętość równą 0,32×10 -3 m 3 .
Przykład 2. Obliczanie gęstości względnej gazu na podstawie jego masy cząsteczkowej.
Oblicz gęstość etanu C 2 H 6 w oparciu o wodór i powietrze.
Rozwiązanie. Z prawa Avogadra wynika, że gęstość względna jednego gazu do drugiego jest równa stosunkowi mas cząsteczkowych ( M godz) tych gazów, tj. D=M1/M2. Jeśli M 1 C2H6 = 30, M 2 H2 = 2, średnia masa cząsteczkowa powietrza wynosi 29, wówczas gęstość względna etanu względem wodoru wynosi D H2 = 30/2 =15.
Gęstość względna etanu w powietrzu: powietrze D= 30/29 = 1,03, tj. etan jest 15 razy cięższy od wodoru i 1,03 razy cięższy od powietrza.
Przykład 3. Oznaczanie średniej masy cząsteczkowej mieszaniny gazów na podstawie gęstości względnej.
Oblicz średnią masę cząsteczkową mieszaniny gazów składającej się z 80% metanu i 20% tlenu (objętościowo), wykorzystując względne gęstości tych gazów w stosunku do wodoru.
Rozwiązanie. Często obliczenia wykonuje się zgodnie z zasadą mieszania, która stwierdza, że stosunek objętości gazów w dwuskładnikowej mieszaninie gazów jest odwrotnie proporcjonalny do różnic między gęstością mieszaniny a gęstościami gazów tworzących tę mieszaninę . Oznaczmy gęstość względną mieszaniny gazów względem wodoru przez D H2. będzie większa niż gęstość metanu, ale mniejsza niż gęstość tlenu:
80D H2 – 640 = 320 – 20 D H2; D H2 = 9,6.
Gęstość wodoru tej mieszaniny gazów wynosi 9,6. średnia masa cząsteczkowa mieszaniny gazów M H2 = 2 D H2 = 9,6×2 = 19,2.
Przykład 4. Obliczanie masy molowej gazu.
Masa gazu 0,327×10 -3 m 3 w temperaturze 13 0 C i pod ciśnieniem 1,040×10 5 Pa jest równa 0,828×10 -3 kg. Oblicz masę molową gazu.
Rozwiązanie. Masę molową gazu można obliczyć za pomocą równania Mendelejewa-Clapeyrona:
Gdzie M– masa gazu; M– masa molowa gazu; R– stała molowa (uniwersalna) gazu, której wartość wyznaczają przyjęte jednostki miary.
Jeśli ciśnienie mierzy się w Pa, a objętość w m3, to R=8,3144×10 3 J/(kmol×K).
Oprócz masy i objętości w obliczeniach chemicznych często wykorzystuje się ilość substancji proporcjonalną do liczby jednostek strukturalnych zawartych w substancji. W każdym przypadku należy wskazać, o które jednostki strukturalne (cząsteczki, atomy, jony itp.) chodzi. Jednostką ilości substancji jest mol.
Mol to ilość substancji zawierająca tyle cząsteczek, atomów, jonów, elektronów lub innych jednostek strukturalnych, ile atomów znajduje się w 12 g izotopu węgla 12C.
Liczbę jednostek strukturalnych zawartych w 1 molu substancji (stała Avogadra) określa się z dużą dokładnością; w obliczeniach praktycznych przyjmuje się, że jest to 6,02 1024 mol -1.
Nie jest trudno wykazać, że masa 1 mola substancji (masa molowa), wyrażona w gramach, jest liczbowo równa względnej masie cząsteczkowej tej substancji.
Zatem względna masa cząsteczkowa (lub w skrócie masa cząsteczkowa) wolnego chloru C1g wynosi 70,90. Dlatego masa molowa cząsteczkowego chloru wynosi 70,90 g/mol. Jednakże masa molowa atomów chloru jest o połowę mniejsza (45,45 g/mol), ponieważ 1 mol cząsteczek chloru Cl zawiera 2 mole atomów chloru.
Zgodnie z prawem Avogadra równe objętości dowolnych gazów pobranych w tej samej temperaturze i pod tym samym ciśnieniem zawierają tę samą liczbę cząsteczek. Innymi słowy, ta sama liczba cząsteczek dowolnego gazu zajmuje tę samą objętość w tych samych warunkach. Jednocześnie 1 mol dowolnego gazu zawiera tę samą liczbę cząsteczek. W rezultacie w tych samych warunkach 1 mol dowolnego gazu zajmuje tę samą objętość. Objętość ta nazywana jest objętością molową gazu i w normalnych warunkach (0°C, ciśnienie 101,425 kPa) wynosi 22,4 litra.
Na przykład stwierdzenie „zawartość dwutlenku węgla w powietrzu wynosi 0,04% (obj.)” oznacza, że przy ciśnieniu cząstkowym CO 2 równym ciśnieniu powietrza i w tej samej temperaturze dwutlenek węgla zawarty w powietrzu pochłonie aż o 0,04% całkowitej objętości zajmowanej przez powietrze.
Zadanie testowe
1. Porównaj liczbę cząsteczek zawartych w 1 g NH 4 i 1 g N 2. W jakim przypadku i ile razy liczba cząsteczek jest większa?
2. Wyraź masę jednej cząsteczki dwutlenku siarki w gramach.
4. Ile cząsteczek znajduje się w 5,00 ml chloru w standardowych warunkach?
4. Jaką objętość w normalnych warunkach zajmuje 27 10 21 cząsteczek gazu?
5. Wyraź masę jednej cząsteczki NO 2 w gramach -
6. Jaki jest stosunek objętości zajmowanych przez 1 mol O2 i 1 mol Oz (warunki są takie same)?
7. W tych samych warunkach pobiera się równe masy tlenu, wodoru i metanu. Znajdź stosunek objętości pobranych gazów.
8. Na pytanie, ile objętości zajmie 1 mol wody w normalnych warunkach, odpowiedź brzmiała: 22,4 litra. Czy to jest poprawna odpowiedź?
9. Wyraź masę jednej cząsteczki HCl w gramach.
Ile cząsteczek dwutlenku węgla znajduje się w 1 litrze powietrza, jeśli objętość objętościowa CO 2 wynosi 0,04% (warunki normalne)?
10. Ile moli znajduje się w 1 m 4 dowolnego gazu w normalnych warunkach?
11. Wyraź w gramach masę jednej cząsteczki H 2 O-
12. Ile moli tlenu znajduje się w 1 litrze powietrza, jeśli objętość
14. Ile moli azotu znajduje się w 1 litrze powietrza, jeśli jego zawartość objętościowa wynosi 78% (warunki normalne)?
14. W tych samych warunkach pobiera się równe masy tlenu, wodoru i azotu. Znajdź stosunek objętości pobranych gazów.
15. Porównaj liczbę cząsteczek zawartych w 1 g NO 2 i 1 g N 2. W jakim przypadku i ile razy liczba cząsteczek jest większa?
16. Ile cząsteczek znajduje się w 2,00 ml wodoru w warunkach normalnych?
17. Wyraź w gramach masę jednej cząsteczki H 2 O-
18. Jaką objętość w normalnych warunkach zajmuje 17 10 21 cząsteczek gazu?
SZYBKOŚĆ REAKCJI CHEMICZNYCH
Podczas definiowania pojęcia szybkość reakcji chemicznej konieczne jest rozróżnienie reakcji jednorodnych i heterogenicznych. Jeśli reakcja zachodzi w układzie jednorodnym, na przykład w roztworze lub mieszaninie gazów, to zachodzi ona w całej objętości układu. Szybkość jednorodnej reakcji to ilość substancji, która reaguje lub powstaje w wyniku reakcji w jednostce czasu na jednostkę objętości układu. Ponieważ stosunek liczby moli substancji do objętości, w której jest ona rozprowadzona, jest stężeniem molowym substancji, szybkość reakcji jednorodnej można również zdefiniować jako zmiana stężenia w jednostce czasu dowolnej substancji: odczynnika początkowego lub produktu reakcji. Aby wynik obliczeń był zawsze dodatni, niezależnie od tego, czy dotyczy on odczynnika, czy produktu, we wzorze stosuje się znak „±”:
W zależności od charakteru reakcji czas można wyrazić nie tylko w sekundach, jak wymaga tego układ SI, ale także w minutach lub godzinach. Podczas reakcji wielkość jej szybkości nie jest stała, ale stale się zmienia: maleje wraz ze spadkiem stężeń substancji wyjściowych. Z powyższego obliczenia wynika średnia wartość szybkości reakcji w pewnym przedziale czasu Δτ = τ 2 – τ 1. Prędkość rzeczywistą (chwilową) definiuje się jako granicę, do której dąży stosunek Δ Z/ Δτ przy Δτ → 0, tj. rzeczywista prędkość jest równa pochodnej stężenia po czasie.
W przypadku reakcji, której równanie zawiera współczynniki stechiometryczne różniące się od jedności, wartości szybkości wyrażone dla różnych substancji nie są takie same. Na przykład dla reakcji A + 4B = D + 2E zużycie substancji A wynosi jeden mol, ilość substancji B wynosi trzy mole, a podaż substancji E wynosi dwa mole. Dlatego υ (A) = ⅓ υ (B) = υ (D) =½ υ (E) lub υ (E) . = ⅔ υ (W) .
Jeżeli reakcja zachodzi pomiędzy substancjami znajdującymi się w różnych fazach układu heterogenicznego, to może ona zachodzić jedynie na styku tych faz. Na przykład interakcja między roztworem kwasu a kawałkiem metalu zachodzi tylko na powierzchni metalu. Szybkość reakcji heterogenicznej to ilość substancji, która reaguje lub powstaje w wyniku reakcji w jednostce czasu na jednostkę powierzchni styku:
 .
.
Zależność szybkości reakcji chemicznej od stężenia reagentów wyraża prawo działania mas: w stałej temperaturze szybkość reakcji chemicznej jest wprost proporcjonalna do iloczynu stężeń molowych reagujących substancji podniesionych do potęg równych współczynnikom we wzorach tych substancji w równaniu reakcji. Potem dla reakcji
2A + B → produkty
stosunek jest ważny υ ~ · Z 2 · Z B, a do przejścia do równości wprowadza się współczynnik proporcjonalności k, zwany stała szybkości reakcji:
υ = k· Z 2 · Z B = k·[A] 2 ·[B]
(stężenia molowe we wzorach można oznaczyć literą Z z odpowiednim indeksem i wzorem substancji ujętym w nawiasy kwadratowe). Fizyczne znaczenie stałej szybkości reakcji to szybkość reakcji przy stężeniach wszystkich reagentów równych 1 mol/l. Wymiar stałej szybkości reakcji zależy od liczby czynników po prawej stronie równania i może wynosić c –1 ; s –1 ·(l/mol); s –1 · (l 2 /mol 2) itd., to znaczy tak, że w każdym przypadku w obliczeniach szybkość reakcji wyraża się w mol · l –1 · s –1.
W przypadku reakcji heterogenicznych równanie prawa działania masy obejmuje stężenia tylko tych substancji, które znajdują się w fazie gazowej lub w roztworze. Stężenie substancji w fazie stałej jest wartością stałą i jest uwzględniane w stałej szybkości, na przykład dla procesu spalania węgla C + O 2 = CO 2 zapisano prawo działania masy:
υ = kI·stała··= k·,
Gdzie k= kI konst.
W układach, w których jedna lub więcej substancji jest gazem, szybkość reakcji zależy również od ciśnienia. Na przykład, gdy wodór oddziałuje z parami jodu H 2 + I 2 = 2HI, szybkość reakcji chemicznej zostanie określona przez wyrażenie:
υ = k··.
Jeśli ciśnienie zwiększymy np. 4-krotnie, to objętość zajmowana przez układ zmniejszy się o tę samą ilość, a co za tym idzie, stężenia każdej z reagujących substancji wzrosną o tę samą ilość. Szybkość reakcji w tym przypadku wzrośnie 9 razy
Zależność szybkości reakcji od temperatury opisane przez regułę van't Hoffa: przy każdym wzroście temperatury o 10 stopni szybkość reakcji wzrasta 2-4 razy. Oznacza to, że wraz ze wzrostem temperatury w postępie arytmetycznym szybkość reakcji chemicznej rośnie wykładniczo. Podstawą formuły progresji jest współczynnik temperaturowy szybkości reakcjiγ, pokazujący, ile razy wzrasta szybkość danej reakcji (lub, co jest tym samym, stała szybkości) wraz ze wzrostem temperatury o 10 stopni. Matematycznie regułę Van't Hoffa wyrażają wzory:
 Lub
Lub 
gdzie i są odpowiednio szybkościami reakcji na początku T 1 i ostateczny T 2 temperatury. Regułę Van't Hoffa można również wyrazić za pomocą następujących relacji:
![]() ;
;  ;
; ![]() ;
;  ,
,
gdzie i oznaczają odpowiednio szybkość i stałą szybkości reakcji w temperaturze T; i – te same wartości w temperaturze T +10N; N– liczba przedziałów „dziesięciostopniowych” ( N =(T 2 –T 1)/10), o który zmieniła się temperatura (może być liczbą całkowitą lub ułamkową, dodatnią lub ujemną).
Zadanie testowe
1. Znajdź wartość stałej szybkości reakcji A + B -> AB, jeżeli przy stężeniach substancji A i B równych odpowiednio 0,05 i 0,01 mol/l, szybkość reakcji wynosi 5 10 -5 mol/(l -min).
2. Ile razy zmieni się szybkość reakcji 2A + B -> A2B, jeśli stężenie substancji A wzrośnie 2 razy, a stężenie substancji B zmniejszy się 2 razy?
4. Ile razy należy zwiększyć stężenie substancji B 2 w układzie 2A 2 (g) + B 2 (g) = 2A 2 B (g), aby przy zmniejszeniu stężenia substancji A 4-krotnie , szybkość reakcji bezpośredniej nie zmienia się?
4. Jakiś czas po rozpoczęciu reakcji 3A+B->2C+D stężenia substancji wynosiły: [A] =0,04 mol/l; [B] = 0,01 mol/l; [C] = 0,008 mola/l. Jakie są początkowe stężenia substancji A i B?
5. W układzie CO + C1 2 = COC1 2 zwiększono stężenie z 0,04 do 0,12 mol/l, a stężenie chloru z 0,02 do 0,06 mol/l. Ile razy wzrosła szybkość reakcji do przodu?
6. Reakcję pomiędzy substancjami A i B wyraża równanie: A + 2B → C. Początkowe stężenia wynoszą: [A] 0 = 0,04 mol/l, [B] o = 0,05 mol/l. Stała szybkości reakcji wynosi 0,4. Znajdź początkową szybkość reakcji i szybkość reakcji po pewnym czasie, gdy stężenie substancji A zmniejszy się o 0,01 mol/l.
7. Jak zmieni się szybkość reakcji 2CO + O2 = 2CO2 zachodzącej w zamkniętym naczyniu, jeśli ciśnienie wzrośnie dwukrotnie?
8. Oblicz, ile razy szybkość reakcji wzrośnie, jeśli temperatura układu wzrośnie z 20 °C do 100 °C, przyjmując wartość współczynnika temperaturowego szybkości reakcji równą 4.
9. Jak zmieni się szybkość reakcji 2NO(r.) + 0 2 (g.) → 2N02(r.) jeśli ciśnienie w układzie wzrośnie 4-krotnie;
10. Jak zmieni się szybkość reakcji 2NO(r.) + 0 2 (g.) → 2N02(r.) jeśli objętość układu zmniejszymy 4-krotnie?
11. Jak zmieni się szybkość reakcji 2NO(r.) + 0 2 (g.) → 2N02(r.) jeśli stężenie NO wzrośnie 4-krotnie?
12. Jaki jest współczynnik temperaturowy szybkości reakcji, jeśli przy wzroście temperatury o 40 stopni szybkość reakcji
wzrasta o 15,6 razy?
14. . Znajdź wartość stałej szybkości reakcji A + B -> AB, jeżeli przy stężeniach substancji A i B równych odpowiednio 0,07 i 0,09 mol/l, szybkość reakcji wynosi 2,7 · 10 -5 mol/(l-min ).
14. Reakcję pomiędzy substancjami A i B wyraża równanie: A + 2B → C. Początkowe stężenia wynoszą: [A] 0 = 0,01 mol/l, [B] o = 0,04 mol/l. Stała szybkości reakcji wynosi 0,5. Znajdź początkową szybkość reakcji i szybkość reakcji po pewnym czasie, gdy stężenie substancji A zmniejszy się o 0,01 mol/l.
15. Jak zmieni się szybkość reakcji 2NO(r.) + 0 2 (g.) → 2N02(r.) jeśli ciśnienie w układzie wzrośnie dwukrotnie;
16. W układzie CO + C1 2 = COC1 2 zwiększono stężenie z 0,05 do 0,1 mol/l, a stężenie chloru z 0,04 do 0,06 mol/l. Ile razy wzrosła szybkość reakcji do przodu?
17. Oblicz, ile razy szybkość reakcji wzrośnie, jeśli temperatura układu wzrośnie z 20 °C do 80 °C, przyjmując wartość współczynnika temperaturowego szybkości reakcji równą 2.
18. Oblicz, ile razy szybkość reakcji wzrośnie, jeśli temperatura układu wzrośnie z 40 °C do 90 °C, przyjmując wartość współczynnika temperaturowego szybkości reakcji równą 4.
WIĄZANIE CHEMICZNE. TWORZENIE I STRUKTURA CZĄSTECZEK
1. Jakie znasz rodzaje wiązań chemicznych? Podaj przykład tworzenia wiązania jonowego metodą wiązania walencyjnego.
2. Jakie wiązanie chemiczne nazywa się kowalencyjnym? Czym charakteryzuje się wiązanie kowalencyjne?
4. Jakimi właściwościami charakteryzuje się wiązanie kowalencyjne? Pokaż to na konkretnych przykładach.
4. Jaki rodzaj wiązania chemicznego występuje w cząsteczkach H2; Cl2HC1?
5.Jaka jest natura wiązań w cząsteczkach? NCI 4 CS2, CO2? Wskaż dla każdego z nich kierunek przemieszczenia wspólnej pary elektronów.
6. Jakie wiązanie chemiczne nazywa się jonowym? Czym charakteryzuje się wiązanie jonowe?
7. Jaki rodzaj wiązania występuje w cząsteczkach NaCl, N 2, Cl 2?
8. Narysuj wszystkie możliwe sposoby nakładania się orbitalu s na orbital p. Wskaż kierunek komunikacji w tym przypadku.
9. Wyjaśnić mechanizm donor-akceptor wiązań kowalencyjnych na przykładzie powstawania jonu fosfoniowego [PH 4 ]+.
10. Czy w cząsteczkach CO, C0 2, wiązanie jest polarne czy niepolarne? Wyjaśnić. Opisz wiązanie wodorowe.
11. Dlaczego niektóre cząsteczki posiadające wiązania polarne są na ogół niepolarne?
12.Wiązanie kowalencyjne lub jonowe jest typowe dla związków: Nal, S0 2, KF? Dlaczego wiązanie jonowe jest skrajnym przypadkiem wiązania kowalencyjnego?
14. Co to jest wiązanie metaliczne? Czym to się różni od wiązania kowalencyjnego? Jakie właściwości metali określa?
14. Jaka jest natura wiązań między atomami w cząsteczkach; KHF 2, H 2 0, HNO ?
15. Jak możemy wyjaśnić wysoką siłę wiązania pomiędzy atomami w cząsteczce azotu N2 i znacznie niższą siłę wiązania w cząsteczce fosforu P4?
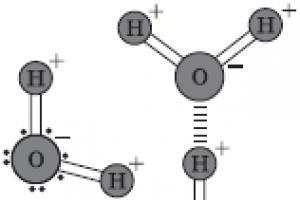
16 . Jakie wiązanie nazywa się wiązaniem wodorowym? Dlaczego tworzenie wiązań wodorowych nie jest typowe dla cząsteczek H2S i HC1, w przeciwieństwie do H2O i HF?
17. Jakie wiązanie nazywamy jonowym? Czy wiązanie jonowe ma właściwości nasycenia i kierunkowości? Dlaczego jest to skrajny przypadek wiązania kowalencyjnego?
18. Jaki rodzaj wiązania występuje w cząsteczkach NaCl, N 2, Cl 2?